由于MTT经还原所产生的甲瓒产物不溶于水,需被溶解后才能检测。这不仅使工作量增加,也会对实验结果的准确性产生影响,而且溶解甲瓒的有机溶剂对实验者也有损害。关于MTT法,上次中洪君也有推送过:实验专栏丨这5年做MTT实验的总结都在这儿了。
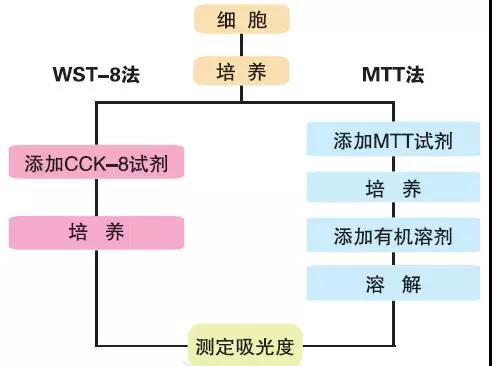
为此,Oween等设计出了一种新型的MTT类似物一MTS,MTS法原理同MTT法,但优于MTT法。MTS在PMs(Phenazinemethosulfate)的存在下可被活细胞还原形成水溶性的甲增产物(故MTS需与PMS合用),因而被用来建立了可检测细胞活力和增殖能力的MTS检测法。 MTS形成的水溶性甲腊产物在490~500nm处有最佳吸收,我们一般选择492nm。每孔检测的细胞数量在3000~5000为宜,作用一小时后即可检测,以3小时的检测结果为最佳。
与MTT法相比,MTS有以下优点
➤ 1、操作简便,MTS中生成的甲脂极具水溶性,省去了MTT法需离心除去上清液和加入有机溶剂这一步骤,可一次检测大量样品。
➤ 2、MTS易于配制和储存,在PH>6.5的缓冲溶液中易溶解配成溶液,且可在4 ℃下保存一段时间。
➤ 3、快速,加入药后一小时即可检测结果(2-3小时为最佳),而MTT法的作用4个小时。
➤ 4、敏感,比MTT法测定统一样品敏感性高。
➤ 5、特异性强,MTT法形成的甲增产物为桔黄色,培养体系中一些黄色代谢产物和试剂均可影响检测结果,而MTS/PMS法形成的甲增产物为深棕色检测时外部因素影响较小,所以特异性较强。
➤ 6、重复性良好。
MTS法的原理:
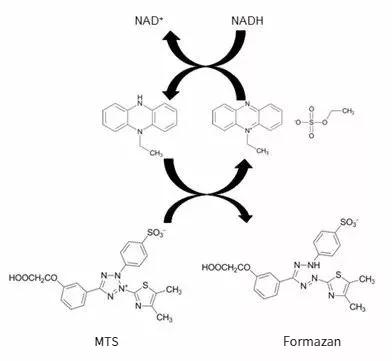
还原为黄色的Fo图为MTS被乳酸脱氢酶rmazan
MTS检测细胞增殖protocol:
1)收集对数期细胞,调整细胞悬液浓度,每孔加入100ul,铺板使待测细胞调密度3000~5000/孔,5%CO2,37℃孵育。
2)24小时后吸去培养基,每孔加入100ulMTS溶液,即MTS母液与培养基比例为1:9,继续培养1-3h。在酶标仪OD492nm处测量各孔的吸光值。
3)连续检测3天,每天3复孔,在酶标仪OD490nm处测量各孔的吸光值。
4)记录3天的各孔吸光值,使用GraphPad prism软件计算细胞增殖曲线。
MTS操作注意事项:
1、MTS需避光,所以操作时应注意避光。
2、培养过程中换液,如果培养时间较长,应适当更换细胞培养液,补充营养物质。
3、防止边缘效应,96孔板边缘应该滴加PBS,边缘孔的水分挥发较快,药物易被浓缩,对实验影响大。边缘孔加入PBS 溶液后能够在一定程度上保持实验组的水分。
中洪实验室细胞增殖检测法推荐
1、细胞类型,如果是悬浮细胞,MTT方法则不适用,MTT需要吸取上清后再加入DMSO溶解甲臜,而悬浮细胞不贴壁,容易造成结果不准确 。
2、细胞数,如果细胞数少于500,则推荐使用基于ATP的检测方法,该方法较为灵敏,能够检测很少的细胞数。
3、检测时间,如果实验时间不允许,需要短时间出稳定准确的实验结果,推荐采用基于其他氧化还原酶的检测和基于ATP的检测方法。
4、药物处理。如有药物处理,且药物具有氧化性,则不推荐MTT, 氧化性的药物会和MTT发生氧化还原反应而影响MTT法的试验结果。另外如果药物带有颜色,推荐采用基于ATP的检测方法。
5、高通量筛选。推荐采用MTS,CCK-8这两种方法,操作较为简单,且价格便宜。但如果是药物的高通量筛选,且药物处理时间较短,带有颜色,推荐采用基于ATP的检测方法。
——————中洪博元其他部分实验展示——————