

细胞焦亡:宿主细胞死亡和炎症
真核细胞可以启动几种不同的自我毁灭程序,而细胞死亡过程的性质(非炎症性或促炎性)指示着邻近细胞的反应。这反过来又决定了重要的系统生理结果。细胞可以通过不同的生化途径死亡,产生不同的形态和生理结果。细胞凋亡可能是最普遍的细胞死亡程序,它机械性的可以定义是对特定半胱氨酸依赖的天冬氨酸蛋白酶(caspase)的需求,后者产生细胞的有序分解。凋亡细胞常常伴随着细胞质浓缩和核固缩,DNA片段化,质膜完整同时伴随着凋亡小体的产生。细胞凋亡产生的凋亡小体,它们是体内吞噬细胞吞噬和清除的靶点,导致出现炎症反应。
虽然凋亡是第一个公认的真核细胞死亡程序,但“程序性细胞死亡”被广泛的应用于几种内源性基因界定的途径,细胞在自己的毁灭中也起到了积极的作用。其他的细胞死亡程序包括自噬、肿大和caspase-1依赖的细胞程序性死亡(细胞焦亡)。细胞焦亡是最近才发现的一种宿主细胞死亡途径,由一系列因素包括微生物感染(例如沙门氏菌,弗朗西丝菌和军团菌)和非传染性志贺氏菌刺激,包括心肌梗死期间等产生的宿主死亡方式。
在这篇综述中主要围绕:焦亡,炎性宿主反应;感知宿主和微生物产生的“危险”信号会导致两种截然不同的结果:细胞活化和细胞死亡;炎症组分和炎症复合体的可视化;caspase- 1在健康和疾病中的激活:对抗感染和病理性炎症;焦亡易感性受病原和宿主对caspase-1活化的调控,通过这几个方面来描述,细胞焦亡的主要特征,焦亡过程中caspase的激活、导致焦亡的主要炎症组分和炎症体复合物、焦亡的易感性。
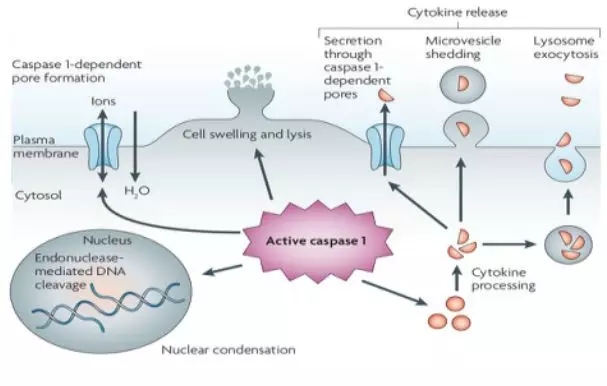
Caspase -1在多种刺激下被切割和激活,但一旦被激活,caspase-1就会产生一个保守的细胞死亡程序,称为焦亡。有研究表明,caspase-1依赖的细胞死亡方式,其产生机制,特征和结果与凋亡不同。caspase -1的激活还能快速形成直径为1.1-2.4nm的质膜孔。这些孔隙消散细胞离子梯度,允许水流入,细胞肿胀和渗透溶解。Caspase-1激活后可引起IL-1β和IL-18的前体成熟成熟,在焦亡过程中释放,但分泌的确切机制仍存在争议。分泌的过程与caspase -1依赖的孔形成有关,提示这些孔促进细胞因子的释放。其他提示的分泌机制包括caspase -1无关的溶酶体外吞和微囊脱落。Caspase 1活性通过一种未知的内切酶导致染色体DNA的断裂。DNA的断裂不会导致凋亡过程中观察到的寡核体片段。核凝聚也被观察到,但核完整性被保持,不像在凋亡期间观察到的核碎裂。
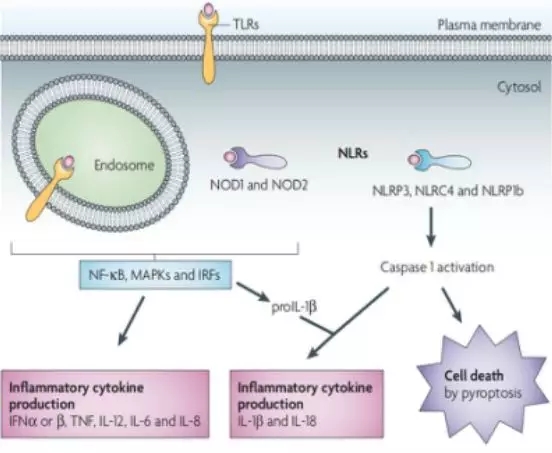
Tol-like受体(Tol-like Receptor,TLRs)是一种含有LRR的跨膜蛋白,可检测细胞外环境和内小体内的危险信号。TLRs启动信号级联,通过核因子-κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)和干扰素(IFN)-调节因子(Irf)-deendende激活细胞。和炎性细胞因子(包括IFNα、IFNβ、肿瘤坏死因子(TNF)、白细胞介素-12(IL-12)、IL-6、IL-8和IL-1β的产生。NOD样受体(NLRs)在识别引入宿主细胞胞浆的危险信号中起着重要作用。与TLRs一样,NOD 1(核苷酸结合寡聚区蛋白1)和NOD 12刺激可促进细胞因子的产生。NLRs的另一部分介导半胱氨酸蛋白酶caspase 1的激活,该酶触发caspase 1依赖的细胞死亡(焦亡)以及炎症细胞因子IL-18和IL-1β的处理和释放。
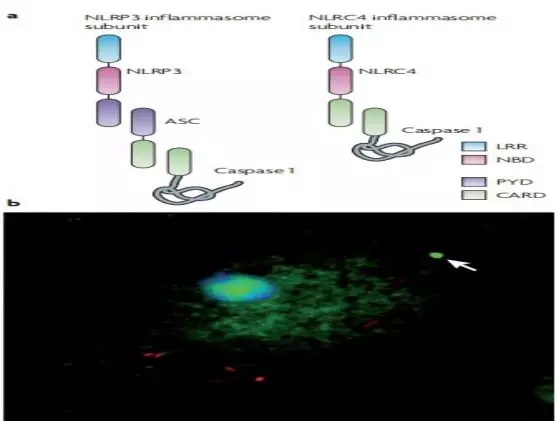
NOD样受体(NLR)的亮氨酸丰富重复序列(LRR)结构域与细胞内一系列的“危险”信号有关。配体识别后,核苷酸结合和寡聚结构域(NBD)介导NLRs的核苷酸依赖自联想.一些NLRs,如 NLRP3 (NACHT, LRR 和PYD结构域-包含的蛋白3;也称为NALP 3),包含与适配器蛋白ASC相互作用的pyrin(PYD)结构域。ASC包含一个caspase激活和招募域(CARD),它结合和促进caspase 1的激活。其他NLRs,如NLRC4(NLR家族卡域蛋白4,又称IPAF),含有CARD,可直接与caspase 1相互作用。然而,ASC是NLRC4依赖的caspase 1激活所必需的,这表明ASC可能参与NLRC4炎症小体的形成,或在caspase 1的激活中发挥额外的作用。巨噬细胞的沙门氏菌(红色)感染导致caspase 1(绿色)的激活,用荧光标记的活性酶抑制剂在这里显示。活性caspase 1通常集中在单个焦点内(箭头所示),并在细胞质中扩散分布。活性caspase 1在炭疽杆菌致死毒素处理的巨噬细胞中有相似的分布。
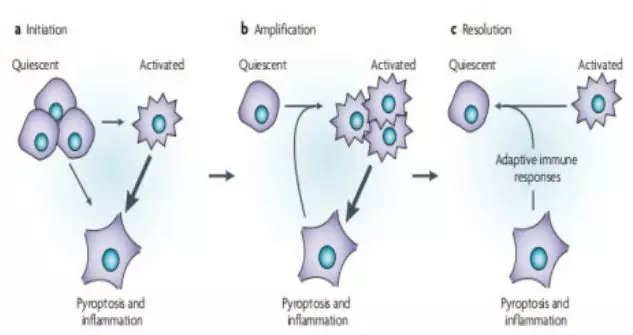
Caspase-1活化会使白细胞介素18(IL-18)、IL-1β和其他炎症细胞内的内容物被切割和释放。静止的细胞也会受到炎症介质的“激活”,从而降低caspase -1激活和焦亡的阈值,并刺激IL-1β分泌的增加。随着感染的进展,由于焦亡而发生的炎症会导致激活细胞数量的增加,并增加了炎症。焦亡过程中产生的炎症物质吸收和激活免疫细胞,刺激适应性免疫反应的发展。这有助于控制和最终解决微生物感染,并使组织恢复到静止状态。另外,caspase -1的激活可能是有害的,因为NOD样受体(Nlr)蛋白的突变或无菌炎症刺激的持续会导致不适当和/或过量caspase -1激活。这一过程产生的炎症增加了活化细胞的数量,这些细胞有可能发生焦亡,并表达更高水平的IL-1β,并且扩增周期仍在继续。这增强了反应,维持了炎症状态,如果不间断的话,就会导致病理。
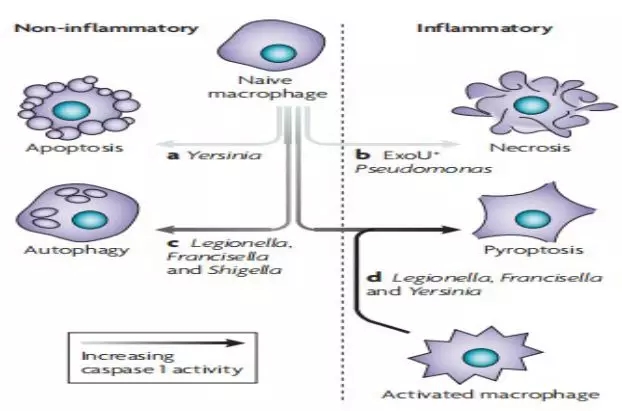
耶尔森菌(a)和假单胞菌(b)移位III型分泌效应,分别导致细胞凋亡和坏死。由于病原体产生不理想的“危险”信号,病原体无法诱导强烈的caspase 1激活(c)。此外,宿主突变可能不允许足够水平的caspase-1激活,以触发焦亡。这些受感染的巨噬细胞通常表现出与自噬相一致的特征。在易感巨噬细胞感染期间,军团杆菌大量产生caspase 1激活的配体,触发了巨噬细胞的吞噬功能(d)。并不是所有的细胞都对焦亡敏感,巨噬细胞的激活增强了caspase-1的激活(图4)对耶尔森氏菌和弗朗西丝菌感染的反应,不会刺激巨噬细胞的吞噬焦亡作用。
▍参考文献:Bergsbaken, T., Fink, S. L., & Cookson, B. T. (2009). Pyroptosis: host cell death and inflammation. Nature Reviews Microbiology, 7(2), 99-109.DOI: 10.1038/nrmicro2070
▍IF:31.851