血清中 miRNA 抽提和实验设计经验谈
发布人:admin
浏览次数:1507
发布时间:2017-11-15
血液中 miRNA 的组成
血液中的 miRNA 到底是从何而来? 要往哪里 去? 这些 miRNA 的生理功能是什么? 以上这三个问题是很多研究人员关心的问题,事实上这些问 题目前并没有很明确的答案,我们知道 miRNA 是 内生性的短片段 RNA,长度约 17 到 23 核苷酸, miRNA 可以藉由和信息 RNA(mRNA)结合诱导 信息 RNA 的降解,进而调控信息 RNA 和相对蛋 白的表现。根据一些论文的揭示 1 和实验室实际的 操作经验显示,正常人的血液中 miRNA 的含量是 极微量的,但是在病人和检体制备不佳的血液样 本中却可抽取到较大量的 miRNA,根据这些观察 现象的合理臆测,病人血清中 miRNA 的来源,很 有可能是因疾病造成的组织坏死或细胞凋亡破裂 而流泄出来的胞内 miRNA,经由病人和正常人的 基因表现的芯片图谱比较,结果也倾向有或无表 现的差异,而非特定 miRNA 表现量上升;换言之,我们观察到相关的研究中,病人的 miRNA 的表 现数目增加了,而分析ㄧ些在正常人和病人中都 有表现的 miRNA,表现量的高、低反而是其次的 表征。因此数据分析的逻辑和方法也必须根据之 而调整,但这些呈现异位性表现(ectopic expression)的 miRNA 并不影响其成为诊断疾病 和预后评估的标志的可能性。已经有一些研究指 出,这些不经常表现在循环系统的 miRNA 可以成 为良好的疾病诊断标志,如 miR-141 可以作为前 列腺癌的指标,miR-499 及 miR-208 和心肌梗塞(myocardial infraction)相关,miR-122 和药物 造成的肝脏损伤有关。
血清中 miRNA 抽提的挑战
1 、检体的备制
血清(serum)好还是血浆(plasma)好?临床上会根据检验的标的来选择血液检体的保存及制备方式,血清和血浆都是来自血液检体的成分,但是根据制备的方式导致本质上含有成分 有所不同。基于制备的方法可知,血清是血液经 由凝血反应后,再经由离心沈淀所得到的上清液。而血浆则是血液在不凝血的状况下,经由离心 去除血球后的液体。然而有文献指出,针对同一 个人的血清和血浆样本抽提出来的 miRNA 的总量作比较,很明显的血清抽提的总量明显比血浆抽 提的来得高,这意谓着制备的方法也会影响 miRNA 的抽提,据推测这些 miRNA 可能是因为 凝血反应,血小板或红血球破裂后释出的物质, 其中包含 miRNA,虽然大部分的实时定量聚合链 反应(q-PCR)验证结果显示,血浆和血液的 miRNA 的表现图谱并无显著差异,然而这个已经 存在的风险,可能在研究设计也是需要被考虑, 因此就理论上来说,是以血浆的检体较适合作为 生物标记的找寻 。
2、检体的备制或保存不良是否可用?
已知血清或血浆中的 miRNA 的来源可能来自胞 内和胞外,尤其是血球(红血球或白血球等),因此 处理方式不当会造成检体的污染,改变 miRNA 的 组成和表现量,造成研究结果的偏差,尤其红血 球的溶血现象影响甚剧,不仅会造成红血球 miRNA 污染而且红血球中的大片段 mRNA 亦会 造成定量的失准和因降解而形成实验的伪阳性产生(图一)。因此备制检体时也要避免造成血球破裂 的动作,如用太细的针头抽血、或检体保存不当 造成溶血、或病人本身因疾病或治疗造成的败血 或溶血现象可能也是必须列入评估的考虑因素。 此外抗凝血剂的使用必须避免使用含有肝素 heparin 的凝血管,已知 heparin 会抑制反转录(reverse transcription)和聚合酶(polymerase)的反应,如果检体会进行 q-PCR 的验证一定要避 免。同样的血液检体也含有抑制反转录和聚合酶 的成分,如果萃取时没有移除干净则会造成后续 实验的失败产生。
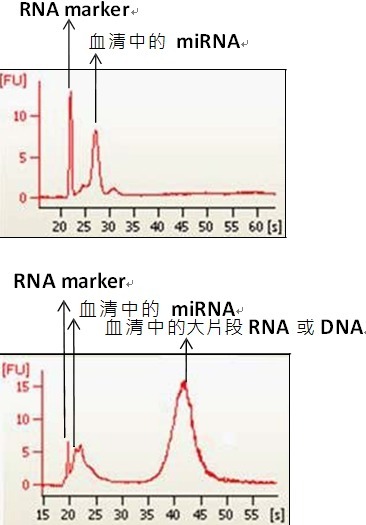
图 一 .为血清抽提 miRNA 后,经由 Agilent Bioanalyzer2100 分析的 RNA 图谱,结果显示提 取成功,提出物中只有 miRNA 片段留存 。图二同图一的实验操作步骤 ,结果显示虽然提取是成功的 , 但是提出物中出现大片断的可疑 DNA 或 RNA 片段 , 可能原始的检体中有溶血的现象等干扰因素 。
miRNA 的定量
在抽提成功的情形下,血清和血浆中仅含有少量的 RNA,1 mL 血的抽提总量可能都在 ng 甚或 pg 等级,这样的结果意谓着,运用现行的分亮度 计来测 OD 是不可行的(以 NaroDrop 为例:待测 浓度需高达 10ng/uL 才可信),而 Agilent bioana- lyzer 2100 也仅能做到定性的检测,没法做精准的 定量。检视现行被使用的定量方法大概有:(一)在 等体积的血清或血液样本中加入外控核酸 (spike),经由抽提步骤后可经由侦测外加的 spike 来校 正抽提的总量及效率,作为校正检体因抽提效率 或误差造成的差异。然而这只适用在检体备制完 美及控制抽取技术无误,对于个体表现差异大和 检体备制质量不一的检体,并没有办法达到管控 的效用;(二)经过分亮度计测 OD 加以定量,但是 除非抽提出的量达到分亮度计的可信水平,否则 这些数值大概都是假讯号,并不足以采信;(三)使用内控基因的表现量来做为校正。但根据研究 指出其实血清或血浆中 miRNA 的表现数量是有很 大的个体差异的,以正常人当研究对象分析其表 现的 miRNA 数量,最低 123 个;最高有 296 个 ,可以有高达两倍的差距,再加上没有适合的内 控基因 (internal control gene)可以做为控制组,公认常用的内控基因 U6 或 SNORD RNAs 等,在个体间的表现也是差异很大并不适用 1,2。因此 透过 Agilent Bioanalyzer 2100 的结果进行 miRNA 相对定量;或从等体积血清抽提出 miRNA 再等比例取出进行实验,似乎是较可信的做法, 但是还是要取决于实验的设计来决定。
结语
当我们理解了实验的设计和预期可能的结果, 避开了可能的干扰因素,做完芯片实验拿到结果 后,可能要先审视一下原始数据再决定要用那种 方法来分析数据,例如;假设控制组只有表现 200 个 miRNA,但是病人组表现 400 个,那经常 被使用的芯片校正方法如:median scaling 或 75th percentile,可能就不适用
(本文转载丁香通)




