5月2日,《细胞生物学杂志》(Journal of Cell Biology)在线发表了题为《视网膜成体干细胞胚胎起源双潜能细胞》的研究论文,该研究由中国科学院上海生命科学研究院神经科学研究所、脑科学与智能技术卓越创新中心何杰研究组完成。该研究采用基于彩虹鱼克隆分析,在单细胞水平上揭示了视网膜干细胞在视网膜睫状边缘区的准确定位;同时在边缘区中发现一类目前尚未报道的静息态细胞。此外,此研究采用原位细胞谱系追踪,阐述了视网膜干细胞胚胎发育的精确细胞谱系,从而揭示视网膜干细胞起源于视泡 (optic vesicle)中间层上皮细胞中的一群双潜能细胞。此项工作发现了视网膜干细胞发育的细胞谱系基础,为进一步揭示视网膜干细胞发育的分子机制,最终实现视网膜干细胞微环境的体外重建提供重要的实验依据。
在低等脊椎动物中,视网膜干细胞位于视网膜睫状边缘区中。在低等脊椎动物一生中,例如斑马鱼,视网膜能够不断增大。整个终生的视网膜生长就是通过视网膜干细胞的增殖和分化而实现的。在进化的过程中,更高等的脊椎动物,视网膜睫状边缘区细胞产生各种视网膜神经元的能力会更弱。但是越来越多的证据表明,在哺乳动物中,视网膜睫状边缘区细胞仍然具备产生新的神经元的潜能,只是在体内环境中,这些潜能被沉默了。其原因目前尚不清晰,这也是神经发育和再生领域一个重大命题。因此,更好地了解低等动物视网膜干细胞的微环境及其胚胎起源,将更有助于了解高等脊椎动物,如哺乳动物视网膜干细胞沉默的原因,为寻找激活这些干细胞的方法提供重要实验依据。
在以往以斑马鱼为模式动物研究视网膜发育的过程中,发现眼柄通过外翻发育成具有中间上皮细胞和外侧上皮细胞的视泡结构,视泡中的中间上皮细胞通过迁移进入外侧上皮细胞,逐渐发育为视杯结构,而视网膜的干细胞就是来源于这群视泡中间上皮细胞。但是对于视网膜干细胞在视网膜中的具体定位以及胚胎视网膜前体细胞发育为视网膜干细胞的精确细胞谱系模式尚不清楚。
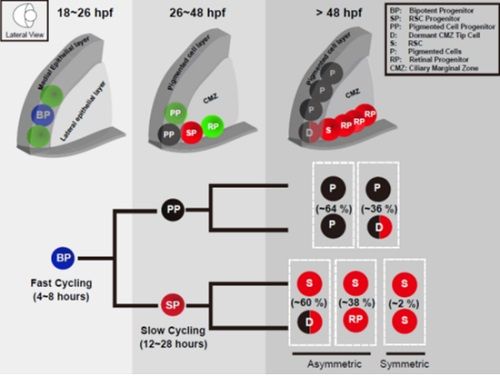
研究团队以斑马鱼为模式动物,采用基于彩虹鱼的克隆分析,将视网膜干细胞精确定位于视网膜睫状边缘区最外周第二层或第三层细胞。相对于视网膜睫状边缘区中其他视网膜前体细胞,视网膜干细胞的细胞周期比较长。此外,研究团队还发现视网膜睫状边缘区最外周第一层细胞是一类完全处于静息状态的新细胞类型。RNA原位杂交实验表明,它们既不表达视网膜干细胞的分子标记,也不表达或者仅微弱表达视网膜色素细胞相关的分子标记。关于这类新的细胞对于视网膜干细胞的维持作用还需要进一步研究。
在准确定位视网膜干细胞的基础上,研究人员进一步寻找视网膜干细胞的胚胎起源。Kaede是一种光转化蛋白,在405nm激光照射下,能够由绿色变为红色。将核定位光转化蛋白nls-kaede的mRNA注射到野生型斑马鱼的胚胎中。在视网膜发育的视泡阶段,对表达Kaede蛋白的视泡中间上皮细胞进行单细胞光转化,通过分析由单个上皮细胞衍生的克隆,研究人员发现:视网膜干细胞只能由视泡中间上皮细胞中一群双潜能细胞产生;这群双潜能细胞产生视网膜干细胞的同时产生视网膜色素细胞,是一群细胞周期比较短的细胞。RNA原位杂交实验表明,这群双潜能细胞既表达视网膜干细胞的分子标记,也表达视网膜色素细胞的标记。而视网膜视泡中间上皮细胞中的其他细胞则只能产生视网膜色素细胞或者视网膜前体细胞。
此工作在单细胞水平上揭示了视网膜睫状边缘区微环境中的细胞类型组成及其特征,为深入探究视网膜干细胞微环境的稳态维持提供了实验基础。此外,双潜能细胞的发现为深入研究视网膜干细胞胚胎发育的分子机制提供了细胞谱系基础,为最终理解视网膜干细胞的产生和维持机制提供可能。
此项工作由助理研究员汤霞和实习生高嘉男在研究员何杰的指导下完成;课题组的贾新玲协助完成了重要的RNA原位杂交实验;研究期间项目还得到了上海生科院健康科学研究所潘巍峻研究团队的协助。该工作获得国家自然科学基金(31471042)和青年千人计划的资助。(转载于生物谷)




