我国科学家与国外学者合作在心肌肥厚早期表观遗传研究方面取得重要进展
发布人:admin
浏览次数:1312
发布时间:2016-10-24
近日,武汉大学与美国加州大学洛杉矶分校合作,在心肌肥厚早期的表观遗传调控机制方面取得重要进展。研究成果以“The long noncoding RNA Chaer defines an epigenetic checkpoint in cardiac hypertrophy”(长链非编码RNA基因Chaer是心肌肥厚表观遗传检查点)为题,于2016年9月12日在 Nature Medicine 在线发表。论文链接:http://www.nature.com/nm/journal/vaop/ncurrent/full/nm.4179.html。武汉大学李红良教授与加州大学洛杉矶分校王义斌教授为文章共同通讯作者,武汉大学王志华教授为第一作者。该研究得到了国家杰出青年科学基金和国家自然科学基金重点项目(项目编号:81425005,81330005)等项目的资助。
心血管疾病是人类健康的第一杀手,以心肌细胞病理性生长为主要特征的肥厚性心脏病是心肌损伤、血管病变等因素诱发的心脏负荷超载的应激性改变,如不能在发病早期阶段对其发病过程进行干预,将不可逆转地诱发心肌细胞死亡、心肌纤维化等病理变化,最终导致心脏功能紊乱、心力衰竭及心源性猝死。李红良研究组长期从事天然免疫网络通路对心血管代谢性疾病的机制研究,近10年来的系统研究发现,天然免疫网络通路可通过非免疫依赖的机制实现对心血管代谢性疾病的调控作用,在心血管疾病的分子机制研究领域具有独到的见解,为探寻防治心脑血管疾病的新靶点提供了重要的实验基础和理论依据。
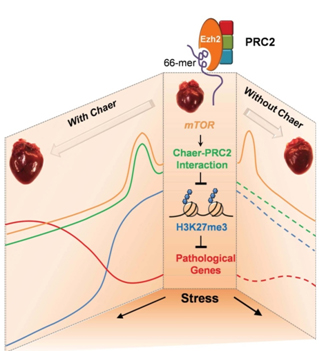
李红良和王义斌研究组的合作研究发现,长链非编码RNA基因Chaer (Cardiac hypertrophy associated epigenetics regulator) 缺失能够显著抑制主动脉狭窄手术诱导的心肌细胞肥厚,减少心肌纤维化,从而改善心脏泵血功能。在相关分子机制上,Chaer通过一段结构独特的66-mer基序特异结合多聚梳抑制复合体II (polycomb repressive complex 2, PRC2),Chaer的结合抑制了PRC2,通过H3组蛋白27位赖氨酸三甲基化(H3K27me3)关闭靶点基因表达的功能,进而使病理相关基因过度表达;Chaer-PRC2相互作用在肥厚性刺激处理的初期被瞬时性增强,该过程受雷帕霉素靶蛋白复合体1 (mechanistic target of rapamycin complex 1, mTORC1)所调控。该研究相关的作用机理如图所示。
该研究发现Chaer是诱发心肌肥厚的早期关键分子开关,揭示了心肌肥厚早期分子机制,为理解心肌肥厚的发病机理提供了新视角,并有望为临床预防、诊断及治疗提供新的突破口。
图 心肌肥厚早期Chaer调控有关基因表达的分子机制