

不同深度皮肤烫伤的动物模型建立
烧烫伤模型的研究主要采用热水烫伤、 蒸汽烫伤等方法造成实验动物烫伤模型,这种造模方法常导致动物皮肤创面边缘不齐, 致伤物温度受环境因素影响较大,烫伤面积和深度不易控制,重复性差, 对后续的实验研究带来许多不便。 因此, 建立标准化的烫伤动物模型是烫伤研究中亟待解决的问题。 我们利用烫伤仪,以大鼠和新西兰兔为研究对象,系统探讨烫伤温度、时间、压力等因素对烫伤深度的影响。
1.1 实验动物
68 只清洁级 SD 大鼠, 雄性,体质量( 280±10 ) g 上海斯莱克实验动物有限公司提供,许可证号: SCXK (沪) 2012-0002 。 46 只普通级新西兰兔,雄性,体质量( 2300±100 ) g ,上海生旺实验动物养殖有限公司, 许可证号: SCXK (沪)2007-0007 。
1.2 仪器
大鼠烫伤模型的制备 实验前将 SD 大鼠用10% 水合氯醛按 0.3 mL/100 g 腹腔注射麻醉。 麻醉后,大鼠背朝上,将背部两侧需烫伤的部位毛剃掉,用脱毛膏脱掉短毛,露出皮肤。 大鼠后肢背部左右两侧各设 1 个烫伤面, 超级控温烫伤仪配套2 cm 2 烫头通电后,烫头设定为压力: 0.5 kg ;温度:80℃ ,时间 2 、 5 、 8 、 10 、 15 s ;温度: 90℃ ,时间 5 、 8 、10 、 12 、 15 、 18 、 20 、 22 、 25 、 28 、 30 s ; 对大鼠背部标记部位进行烫伤。 每个时间点 4 只大鼠,同时设 1个空白对照组,烫后肉眼观察烫伤面,通过不同的时间梯度来验证烫伤深度。 烫伤后 24 h 切取烫伤处皮肤,常规 HE 染色,进行皮肤病理检查。
新西兰兔烫伤模型的制备 实验前将新西兰兔用戊巴比妥钠按 30 mg/kg 耳缘静脉注射,麻醉后,兔背朝上,将兔背部脊柱两侧需烫伤的部位毛剃掉,然后用脱毛膏脱掉短毛,露出皮肤。 兔背部左右两侧各设 2 个烫伤面, 超级控温烫伤仪配套 4 cm 2 烫头通电后,烫头设定为压力: 0.5 kg ;温度: 80℃ ,时间 2 、 5 、 8 、 10 、 15 s ;温度: 90℃ ,时间 5 、8 、 10 、 12 、 15 、 18 、 20 、 22 、 25 、 28 、 30 s ;温度: 95℃ ,时间 25 、 30 、 35 、 40 、 45 、 50 s ;对兔子背部标记部位进行不同时间梯度的烫伤。 每个时间点 2 只兔子,同时设 1 个空白对照组,烫伤后肉眼观察烫伤面。

病理检查
为验证烫伤深度, 烫伤 24 h 后,取空白对照组和烫伤组创面皮肤,经酒精脱水、透明、浸蜡、包埋、切片, HE 染色,进行皮肤病理检查。 烫伤深度的判定按照三度四分法进行划分。根据烫伤所达到的深度、病理变化及临床表现,划分为: Ⅰ 度、浅 Ⅱ 度、深 Ⅱ 度、 Ⅲ 度烫伤。

烫伤外观检查 大鼠皮肤在温度 80℃ 、时间2~10 s ,家兔皮肤在温度 80℃ 、时间 2~15 s 及温度 90℃ 、时间 5 s 条件下,创面颜色微红,随着时间的延长颜色逐渐加深, 创面与周围正常皮肤界限由不明显到逐渐清晰,皮肤质地较软。 大鼠皮肤在温度 80℃ 、 时间 15 s 及温度 90℃ 、 时间 5~12s ,家兔皮肤在温度 90℃ 、时间 8~20 s 条件下,随着时间的延长,创面颜色由红色向局部白色转变,创面与周围正常皮肤有明显的界限, 皮肤质地由软变硬。 大鼠皮肤在温度 90℃ 、时间 15~20 s ,家兔皮肤在温度 90℃ 、时间 22~30 s 条件下,随着时间的延长, 创面颜色由局部白色向全部呈微黄色转变,创面与周围正常皮肤界限明显,皮肤质地变硬并逐渐向外凸起。大鼠皮肤在温度 90℃ 、时间22~30 s ,家兔皮肤在温度 95℃ 、时间 25~50 s 条件下, 随着时间的延长创面颜色由浅黄色向焦黄色转变,创面与周围正常皮肤界限明显,皮肤呈凝固状。
正常大鼠和家兔皮肤表皮、真皮及皮下组织排列整齐有序。大鼠皮肤在温度 80℃ 、时间 2~10 s ,家兔皮肤在温度 80℃ 、时间 2~15 s及温度 90℃ 、时间 5 s 条件下,烫伤表皮呈凝固性坏死,表皮下水肿充血,炎性细胞浸润,为 Ⅰ 度烫伤。 大鼠皮肤在温度 80℃ 、时间 15 s 及温度 90℃ 、时间 5~12 s ,家兔皮肤在温度 90℃ 、时间 8~20 s条件下,烫伤表皮坏死,部分脱落,真皮浅层胶原玻璃样变性,皮肤附属器部分凝固性坏死,为浅 Ⅱ度烫伤。 大鼠皮肤在温度 90℃ 、时间 15~20 s ,家兔皮肤在温度 90℃ 、时间 22~30 s 条件下,表皮坏死,部分脱落,真皮深层胶原变性,皮肤附属器大部分坏死,为深 Ⅱ 度烫伤。大鼠皮肤在温度 90℃ 、时间 22~30 s ,家兔皮肤在温度 95℃ 、时间 25~50 s 条件下,表皮坏死,真皮全层胶原变性,皮肤附属器坏死,皮下疏松结缔组织充血水肿,炎性细胞浸润,为 Ⅲ 度烫伤。
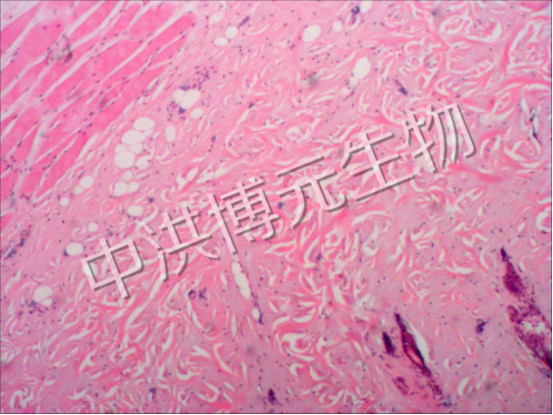
本实验使用的烫伤仪具有烫伤温度、时间、压力、创面面积可控的特点,制备的实验动物皮肤烫伤模型,烫伤深度可控,操作简便,重复性好,是建立不同深度烫伤模型比较理想的方法。 在实验过程中,压力控制在 0.5 kg 较为合适,压力太大易造成动物皮肤下陷, 创面易滑动, 烫伤面积不易控制。 因此,本实验烫伤压力严格控制在 0.5 kg 。 在实验创面位置的选取上, 应选靠近动物脊柱两侧或后肢靠脊柱的部位,这些部位肌肉较多,较为平整,这样致伤后形成的创面深度能保持相对一致。本实验证明了烫伤深度与烫伤温度和时间具有相关性, 烫伤深度随着温度升高、 时间的延长而加深。 本实验我们筛选出的实验大鼠和家兔不同深度烫伤的实验条件, 可为今后的烫伤实验研究提供实验依据。
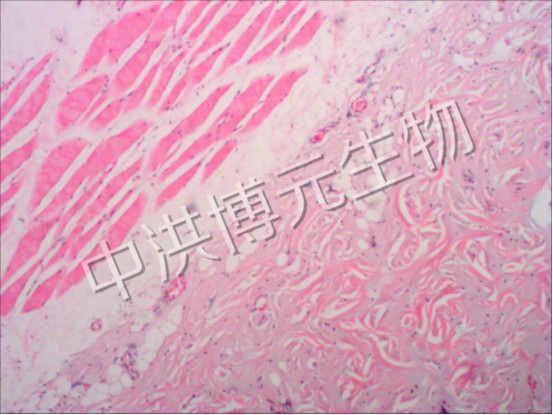
40倍 三度烧伤
急性肾损伤(AKI)是一种临床常见的危重症疾病,其起病急,病程进展快,死亡率及病死率高,且发病率呈逐年上升的趋势[1]。AKI可由感染、烧伤、创伤、肾动脉狭窄及休克等各种原因引起,其中脓毒血症是临床发生AKI的最重要原因之一。在脓毒血症导致AKI的进展过程中,内皮素- 1(ET- 1)及Rho /Rho激酶通路发挥重要作用。ET- 1是目前发现最强的缩血管物质,在脓毒血症等病理情况下,ET- 1合成及释放明显升高,并与内皮素受体结合产生强大而持久的血管收缩效应,从而影响肾组织血液灌注,最终导致AKI。Rho/ Rho激酶是具有信号传导和分子开关作用的信号多肽,参与血管平滑肌收缩、细胞分化及细胞凋亡等多种细胞功能。盐酸法舒地尔作为一种Rho激酶特异性抑制剂,通过阻断Rho /Rho激酶具有扩血管、抗炎等广泛的药理作用。
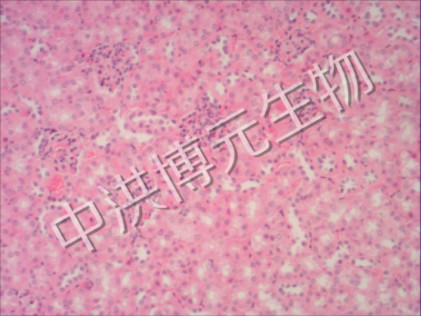
100倍 肾
2.3 标本的采集及检测方法
肾脏病理检查
切片行HE染色观察肾脏病理变化及肾小管损伤程度。肾小管损伤的分级:每张切片× 200倍镜下取外髓质部10个视野,按0是正常,1是轻微损伤(受损肾小管占总肾小管< 5%),2是轻度损伤(受损肾小管占总肾小管的5%~ 25%),3是中度损伤(受损肾小管占总肾小管的25%~ 75%),4是重度损伤(受损肾小管占总肾小管> 75%)作半定量分析并计算其均值,作为肾小管坏死的评分指数。
基础状态观察AKI模型组大鼠腹腔注射LPS后,出现呼吸明显加快,精神萎靡,反应迟钝,皮肤温度明显降低,少动,少食或拒食,尿量减少,尿色加深,个别动物出现血尿。治疗组大鼠的精神状态及活动好于模型组,但不如正常对照组。
肾脏组织病理学变化
(1)AKI模型组可见肾脏体积增大,肾皮质较苍白,髓质淤血,颜色深暗,肾小管由于严重缺血而发生坏死。光镜下可见早期肾小球大致正常,肾小管上皮细胞肿胀、脂肪变性和空泡变性,晚期出现不同程度肾小管上皮细胞坏死,细胞核固缩、溶解、消失。坏死的肾小管上皮细胞脱落入管腔内,呈模糊的颗粒状结构。远端肾小管及集合管内可见小管周围的间质充血、水肿及炎性细胞浸润。(2)治疗组光镜下见部分肾小管上皮细胞轻度肿胀、少量变性与坏死,肾间质无明显改变及炎细胞浸润。
急性肾损伤是一种较常见的临床重、危、急症,可发生于医院内、外、妇产、儿科等。感染导致的脓毒血症是引起AKI最重要的因素之一。近期有资料报告,既便CRE很小(0.3mg dl)幅度的变化也会影响预后。本实验结果显示,腹腔注射LPS l h后,AKI模型组及治疗组CRE、BUN浓度虽无明显升高,但血清ET- 1水平及肾小管坏死评分值已有明显增加,并与肾组织ROCK- Ⅰ表达升高的变化峰值时点相一致,提示在腹腔注射LPS后,ET- 1及ROCK- Ⅰ水平,即可引起肾组织的结构损伤,且可进一步推测LPS可能通过激活Rho Rho激酶通路引起ET- 1的合成及释放增加,进而引起AKI。
(本文转载丁香园)