

除了为克隆基因、预测编码蛋白而需要研究基因的构成外,当前在基因组学上的努力也包括对基因组构成的研究,以分析具有结构和调控因子插入的基因。近源物种分析成为比较基因组学的主要内容,被认为是研究进化、基因功能和人类疾病的重要方法。
利用该方法分析微生物,特别是细菌的基因组,早在 1996 年就已开始识别出细菌中的保守基因和与亚种相关的毒性基因(Fredricks and Reiman 1996)。这方面的进展促生了新的、大规模的检测和识别致病菌的方法。近源种 PCR 可以用来研究进化上相关的种,它们在基因组上有一 些共同的特点,这些保守的区域可被用于在基因组水平识别新种。还可以用该技术在尚未测序的物种的基因组中扩增同源基因。
设计策略
根据多元序列比较和引物设计的一般规律来设计近源种 PCR 引物。通过比较少数几个大的相近序列识别出保守区域,这些区域即是近源种引物的可能结合位点。近源种的比较需要对少数大的相近序列进行精确比对,通过比对找到保守区,作为可能的近源种引物的设计位点。 引物向保守区的退火可被用于在不同种中扩增同源位点(见图 1)。应遵循以下步骤。
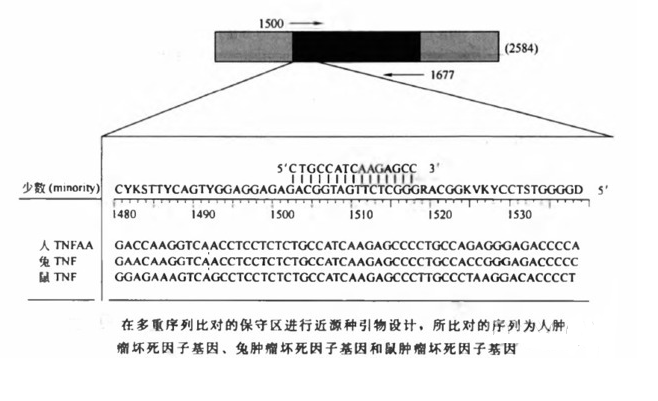
1. 利用多重序列比对软件如 Clustal (http: //www. ebLac.uk/clustalw) 对所选序列进行多重比较。
2. 推测比对中的保守区域。通过选择保守序列的每个位置上最常出现的核苷酸,导出 其共同引物。
3. 引物的结合位点应该完全位于保守区域内。对于亲缘关系较远的种,如果序列不是非常保守,可以设计匹配程度较低的探针或引物。引物的 5'端允许有一定的简并性,但 Y 端的错配将降低退火的特异性和 PCR 的产量(Sommer and Tautz 1989)。
4. 按照 PCR 引物设计的一般规律,避免近源种 PCR 中引物的错配和引物二聚体的 形成。
实时 PCR 探针设计
实时 PCR 的应用使得在 PCR 扩增过程中,就能对核酸的起始量进行精确定量,从而不必进行后 PCR 分析。
在实时 PCR 扩增过程中,用荧光指示剂从 PCR 的起始阶段就开始对 PCR 监测。 随着扩增轮数的持续增加,产物逐渐积累,进而报告分子的荧光也就随之增强。
标记物可以是非特异性的双链 DNA 插入结合染料或序列特异的荧光标记的寡核苷酸探针,寡核苷酸探针用报告荧光染料和猝灭染料标记。
当探针完整时,通过 Forster 共振能量转移(FRET) 作用,猝火物与报告染料的接近大大减少了后者向空间进行的荧光发射,从而会观察到 5 '端有报告物、3'端有猝火物的探针有足够的猝火效应。当探针分子结合进复制子中时,猝火效应被破坏,探针发出荧光。
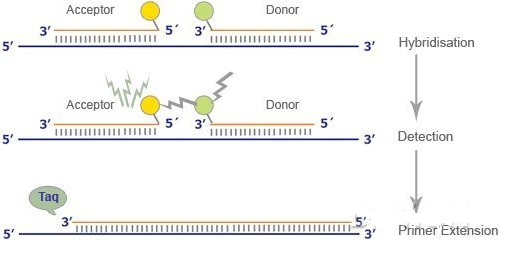
对 PCR 的进程进行实时监测的能力使得以 PCR 为基础的 DNA 和 RNA 定量方法取得突破性进展。通过消除常规定量技术的可变因素的影响,目前已能较可靠地对 PCR 产物进 行定量。由于在外部即可检测荧光,因此不必在反应结束后打开管盖,因而防止了气体浮质 的污染,减少了假阳性结果的数量。
1. 双标 TaqMan 定量分析 (定量 pcr 探针法引物设计)
一个流行的实时 PCR 探针策略是 TaqMan 分析(Applied Biosystems),该实验利用水解探针,它可利用聚合酶的核酸外切酶活性在 PCR 扩增的延伸阶段中切开被标记的杂交探针(Holland etal. 1991)。
(1)设计策略
荧光 5'-核酸酶分析是一个方便而完备的过程。探针被设计为与目的序列退火于上下游引物之间。探针的 5' 端用报告荧光染料.(通常为 6-碳氧荧光素 [6-FAM]) 标记,3'端或任意一个 T 碱基位点用猝火染料(6-羧基-四甲基-罗丹明 [TAMRA]) 标记。
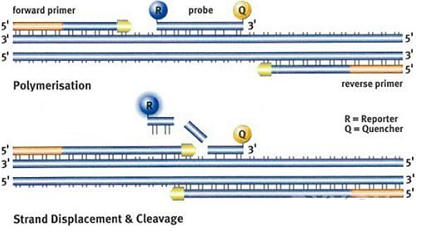
PCR 扩增时,在加入一对引物的同时加入一个特异性的荧光探针。该探针为一线性的寡核苷酸,两端分别标记一个荧光报告基团和一个荧光淬灭基团,探针完整时,报告基团发射的荧光信号被淬灭基团吸收, PCR 仪检测不到荧光信号; PCR 扩增时(在延伸阶段), Taq 酶的 5' - 3' 外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条 DNA 链,就有一个荧光分子形成,实现了荧光信号的累积与 PCR 产物形成完全同步,这也是定量的基础所在。
由于报告基团是随着 PCR 扩增而逐步释放的,因此整个体系的荧光密度值与扩增的 DNA 量成正比。
当设计 TaqMan 探针时,应考虑以下问题:
(1)探针的 3' 端必须保护以防止其在 PCR 扩增时延伸。可以利用 3'-脱氧腺苷、2', 3'双脱氧核苷,插人 T 或猝火染料本身封闭 3'端的磷酸基。TAMRA 或另一个猝火物对 3'端 的标记可利用氨基衔接物实现。也可利用氨基衔接物在合成后以寡核苷酸标记。该法适 用于除 Cy3TM、Cy5TM、Cy5.5TM、HEX 和 TET 之外的所有染料。
(2)探针的 Tm 值应当比扩增引物的 Tm 值髙 10℃,在 65~72℃ 之间,因为此时 Tag 核 酸外切酶活性最高。
(3)避免探针的 5' 端结合一个 G 残基,因之将会在切割后仍猝灭报告物的荧光。
(4)探针中 G 碱基的含量不可多于 C 碱基。
(5)避免单核苷酸重复,特别是 G 残基。
(6)富含 AT 的序列要增加引物和探针的长度,以达到要求的:Tm 值。注意:探针超过 40bp 时会降低猝火效率和减少产量。
(7)探针退火时应尽可能靠近引物,但不要有重叠部分,与引物的 3'端应至少有一个碱 基的距离。
(8)如果 TaqMan 探针是用来区分等位基因的,建议将错配的核苷(多态性位点)放在 探针的中间,而不是末端。探针要尽可能短,以通过错配增加区别能力。
2. 引物和复制子的特性
复制子的大小应该介于 50~150bp, 不应超过 400bp。复制子越短,结果越稳定,因为 这样可使 PCR 更有效率,更不易受反应条件影响。
3. 商用 TaqMan 探针
如果用 TAMRA 作为猝灭剂,只有 3 种荧光染料,即 FAM、HEX 和 TET 可供选择作 为报告染料,由于这些荧光报告染料之间光谱重叠,限制了该探针在多元 PCR 中的应用。
如果使用分子信标的通用猝灭剂 dabcyl,就可有较多的荧光报告染料供选择。dabcyl 可在 TaqMan 探针的 3'端代替 TAMRA, 因此可在探针合成时使用很多种荧光报告剂,从而可在 一个反应中同时监测不同的靶。
4. 用于等位基因鉴别分析的 TaqMan 探针
TaqMan MGB 探针广泛应用于等位基因的鉴别分析,这些探针有以下特点:
(1) 3'端猝灭剂是非荧光的。因猝灭剂不发荧光,报告染料的荧光可被更精确地测量。
(2)3'端有 DNA 小沟结合物质。小沟结合物质可以增加探针的 Tm 值,因此可以使用较 短的探针。因此,已配对和错配的 TaqManMGB 探针之间 Tm 值差异较大,可以更精确地 鉴别等位基因。
(本文转载丁香园)